Moleculen in een vloeistof niet kriskras door elkaar
Bevestiging van lokale moleculaire ordening met behulp van ultrasnelle laserspectroscopie
14 November 2014
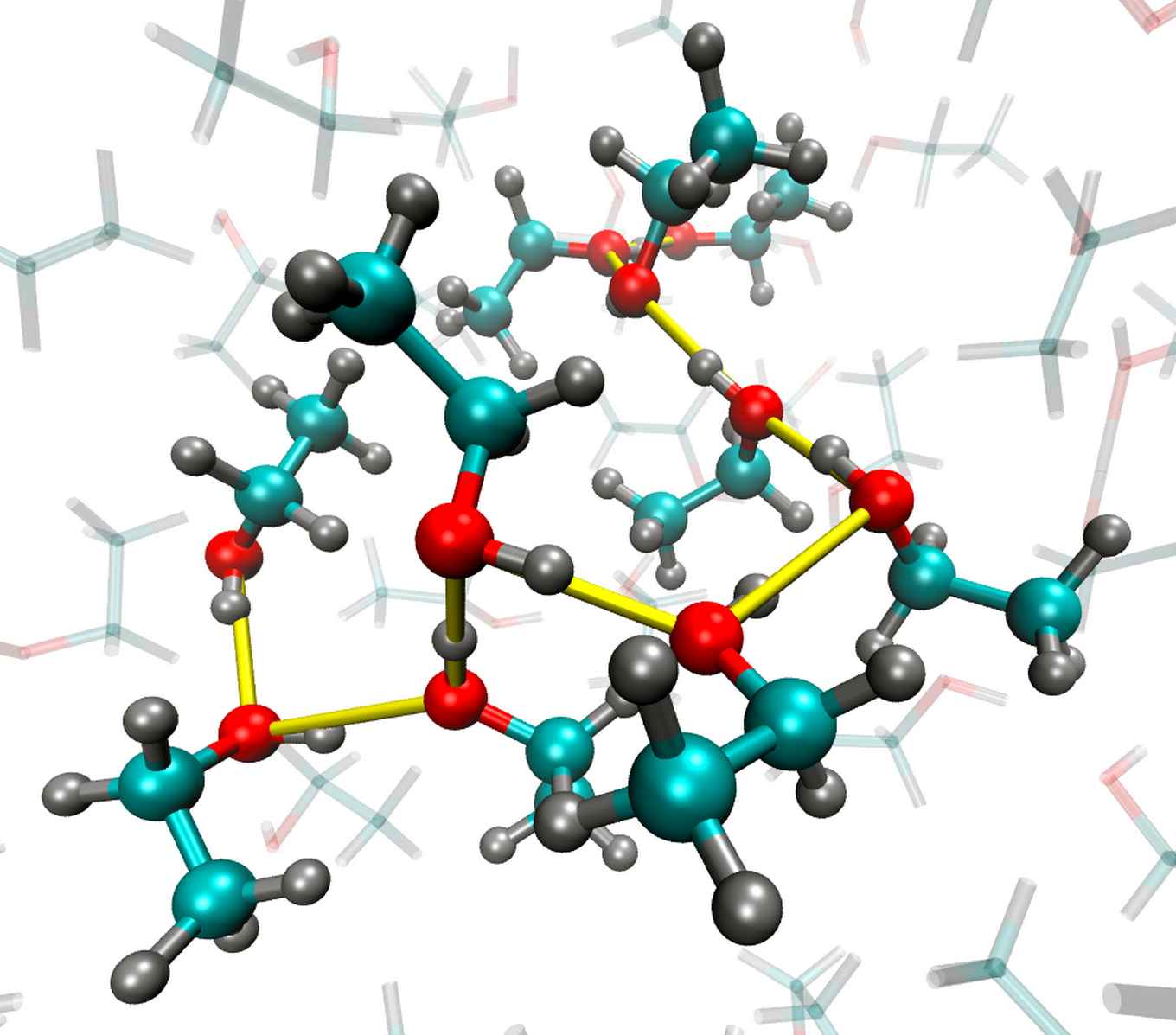
In een vloeistof zitten de moleculen kriskras door elkaar, zo leren we op school. Of is het toch niet helemaal kriskras? Op grond van computersimulaties bestaat al jarenlang het idee dat moleculen in veel vloeistoffen toch een mate van ordening kennen, met name als de moleculen sterke interactie met elkaar hebben (zoals bijvoorbeeld het geval is in water of alcohol).
Matthijs Panman heeft nu laten zien dat dit idee klopt: in alcohol is sprake van lokale oriëntatie-orde. Dat betekent dat naburige moleculen ten opzichte van elkaar een vrij precies bepaalde hoek hebben, terwijl er geen lange-afstand-ordening is zoals bijvoorbeeld in een kristal.
Licht en trillingen

In samenwerking met het Amsterdam Center for Multiscale Modeling bedachten Matthijs Panman, Sander Woutersen en Bernd Ensing een experiment om de lokale orde waar te nemen. De onderzoekers beschenen de alcohol met zeer korte infrarode lichtpulsen van ongeveer een biljoenste van een seconde lang.
Elk alcoholmolecuul bevat een binding tussen zijn zuurstofatoom (O) en waterstofatoom (H). Als het infraroodlicht de juist frequentie heeft, zal bij een deel van de alcoholmoleculen de O-H-binding dankzij resonantie harder gaan trillen. De binding wordt langer en korter, op de maat van de lichtgolf.
Het gebruikte licht is gepolariseerd, wat betekent dat het elektrische veld van het licht een vaste richting heeft. Het licht brengt alleen die O-H-bindingen aan het trillen die parallel staan aan zijn elektrische veld. Vervolgens geven deze trillende bindingen de beweging door aan de O-H-bindingen van buurmoleculen. Deze bindingen hebben immers dezelfde resonantiefrequentie.
Als er een hoek zit tussen de twee naburige O-H-groepen, zullen er na het overspringen van de trilling ook moleculen trillen die niet parallel staan aan het elektrische veld van de infrarode puls. Hoe sterk dit effect is, hangt af van de hoek tussen O-H-bindingen van de buurmoleculen.

120 graden
Door de overdracht van trillingen waar te nemen, konden de onderzoekers de gemiddelde hoek tussen buurmoleculen bepalen. Zij vonden dat de naburige O-H-bindingen in alcohol een hoek van ongeveer 120 graden met elkaar maken. In andere vloeistoffen kan die hoek anders zijn: zo blijken in de vloeistof N-methylacetamide de bindingen tussen het stikstofatoom en het waterstofatoom van naburige moleculen ongeveer parallel aan elkaar te staan.
De lokale orde wordt in beide vloeistoffen veroorzaakt door interacties (waterstofbruggen) tussen de naburige moleculen. Overigens bestaat de lokale orde steeds maar enkele biljoensten van seconden, omdat het netwerk van waterstofbruggen heel dynamisch is: er worden continu waterstofbruggen tussen moleculen verbroken en nieuwe gevormd.
Beter begrip
Het onderzoek biedt een beter begrip van vloeistoffen en het gedrag van hun moleculen. Een goede kennis van vloeistoffen is essentieel om te begrijpen hoe chemische reacties plaatsvinden, en zo hun efficiëntie te kunnen verhogen.
Artikel
M. R. Panman, D. J. Shaw, B. Ensing, and S. Woutersen: Local Orientational Order in Liquids Revealed by Resonant Vibrational Energy Transfer Phys. Rev. Lett. 113, 207801 – Published 12 November 2014.